الجدول الدوري الحديث للعناصر
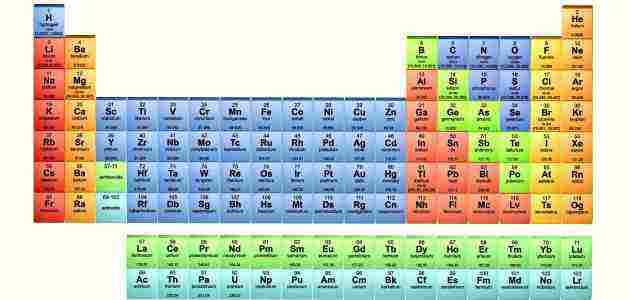
الجدول الدوري الحديث للعناصر هو ترتيب مجدول للعناصر الكيميائية، والتي يتم ترتيبها وفقاً لعددها الذري والتوزيع الإلكتروني والخواص الكيميائية المتكررة، فدعونا نتعرف سوياً من خلال هذا المقال على أهم المعلومات التي تخص الجدول الدوري الحديث للعناصر عبر موقع زيادة
الجدول الدوري الحديث للعناصر

يُمثل الجدول الدوري الحديث اتجاهات دورية بشكل عام، بحيث تُوضع العناصر التي تتمتع بنفس السلوكيات الكيميائية في عمود واحد، وصفوف الجدول تعرف بالدورات أما الأعمدة فتعرف بالمجموعات.
يتم استخدام الجدول الدوري المنظم لاشتقاق العلاقات بين العناصر الكيميائية المختلفة، بالإضافة إلى الخصائص والسلوكيات الكيميائية المتوقعة للعناصر غير المكتشفة، أو التي تم تركيبها حديثاً.
كما أنه مفيد لتحليل التفاعلات الكيميائية، ولا يزال يستخدم على نطاق واسع في الكيمياء والفيزياء النووية والعديد من العلوم الأخرى.
كان الكيميائي الروسي ديمتري مندليف هو أول من قام بنشر الجدول الدوري وكان ذلك في عام 1869م، وبعد ذلك خضع للعديد من التطويرات لتوضيح الاتجاهات الدورية للعناصر المعروفة في ذلك الوقت.
وقد تم توسيع فكرة مندلييف بعد اكتشاف عناصر جديدة من قبل أو توليف، وقام بتطوير نماذج نظرية جديدة تمكنه من شرح السلوك الكيميائي.
ولمعرفة بحث عن الذرة كامل وتركيب الذرة ومراحل اكتشاف الذرة ونظرياتها نوصي بالاطلاع على هذا المقال: بحث عن الذرة كامل وتركيب الذرة ومراحل اكتشاف الذرة ونظرياتها
بنية الجدول الدوري
يمثل الجدول الدوري مجموعة من العناصر الكيميائية، وكل عنصر يحتوي على عدد ذري (z) يمثل عدد من البروتونات في نواتها، وتشتمل معظم العناصر على أعداد مختلفة من النيوترونات مع اختلاف الذرات، والتي يشار إليها بأنها نظائر.
في الجدول الدوري القياسي يتم سرد العناصر بترتيب زيادة العدد الذري، وكل صف جديد (الدورة) يبدأ عندما يحصل غلاف التكافؤ الجديد على أول إلكترون له، ويتم تحديد الأعمدة (المجموعات) حسب التوزيع الإلكتروني للذرة، وكل العناصر التي لها نفس عدد الإلكترونات في مستوى فرعي معين تقع في نفس الأعمدة.
والعناصر التي لها خصائص كيميائية مماثلة تندرج في نفس المجموعة في الجدول الدوري، كما أن العناصر الموجودة في الدورة نفسها في المستوى الفرعي f لها خصائص متشابهة أيضاً، مما يُسهل من التنبؤ بالخصائص الكيميائية لعنصر ما إذا تم التعرف على خصائص العناصر المحيطة به.
مجموعات الجدول الدوري وطريقة ترقيمها
المجموعة بالجدول الدوري هي العمود الرأسي، ويوجد بالجدول 18 مجموعة وجميع العناصر الموجودة داخل كل مجموعة لها نفس تركيب غلاف التكافؤ، من حيث عدد الإلكترونات وهذا الأمر يعطي للعناصر تشابه في الخواص.
يمتاز الجدول الدوري بدقة ترتيب العناصر الكيميائية، حيث أننا كلما انتقلنا من سطر إلى آخر كلما زاد عدد الطبقات، وكلما انتقلنا من عمود لآخر كلما زاد عدد الإلكترونات في الطبقة الخارجية.
يوجد 3 أنظمة لترقيم مجموعات الجدول الدوري وهى الأرقام العربية، الأرقام الرومانية أو المزج بين الأرقام الرومانية والحروف اللاتينية، وقد تم اختيار الترقيم العربي من قبل الاتحاد الدولي للكيمياء والكيمياء التطبيقية.
وقد تم تطوير هذا النظام المقترح من IUPAC ليحل محل الأرقام الرومانية، التي نتج عنها التباس نظراً لكونها كانت تستخدم نفس الأسماء لمعاني مختلفة.
تاريخ الجدول الدوري
كان أرسطو عام 330 قبل الميلاد يعتبر العناصر أربعة فقط وهم الأرض والهواء والنار والماء، وفي عام 1770م قام لافوازييه بتصنيف 33 عنصر وفرق بين الفلزات واللافلزات، وفي عام 1828م قام بصنع جدول للعناصر وأوزانها الذرية ووضع للعناصر رموزها الكيميائية.
في عام 1829م قام دوبرينر بوضع 3 جداول تحتوي على 3 مجموعات كل منهما تضم 3 عناصر متشابهة الخواص، تضم المجموعة الأولى الليثيوم والصوديوم والبوتاسيوم، والثانية تضم الكالسيوم والإسترونشيوم والباريوم، أما المجموعة الثالثة فتضم الكلورين والبرومين واليود.
قام جون نيولاندز في عام 1864م بترتيب 60 عنصر حسب الأوزان الذرية، وقد وجد تشابه بين العنصر الأول والعنصر التاسع، والعنصر الثاني والعنصر العاشر إلى آخره من الترتيب فاقترح قانون اوكتاف.
كان ديمتري مندليف له دور عظيم في تطوير الجدول الدوري وقد أطلق عليه أبو الجدول الدوري للعناصر، إذ أنه لم يقم بترتيب الجدول فقط بل أنه كتب مجلدين بعنوان مبادئ الكيمياء، واستمر في رحلة البحث إلى أن توفى في 20 يناير عام 1907م.
تم اقتراح الجدول الدوري الأصلي دون أن يتم التعرف على التركيب الداخلي للذرات، وبعد ذلك لاحظ الكيميائي الإنجليزي جون نيولاندز أن العناصر ذات الخواص المتشابهة، تتكرر بشكل دوري بمقدار 8 عناصر.
وفي عام 1869م قام الألماني يوليوس لوثر ماير والكيميائي الروسي ديمتري ميندليف، بتطوير أول جدول دوري بترتيب العناصر طبقاً للكتلة.
وقد قام مندليف بتغيير وضع مكان بعض العناصر لأن مكانها الجديد يتماشى مع العناصر الجديدة المجاورة لها، وقد قام بتصحيح بعض الأخطاء في وضع بعض العناصر طبقاً لقيم الكتل الذرية، وتوقع أماكن وجود بعض العناصر التي لم يتم اكتشافها بعد، وقد تم إثبات صحة جدوله لاحقاً بعد اكتشاف التركيب الإلكتروني في القرن 19 – 20.
ولمعرفة ما هو العدد الذري؟ وما هو الجدول الدوري؟ وما الفرق بين العدد الذري والرقم الكتلي؟ نوصي بالاطلاع على هذا المقال: ما هو العدد الذري؟ وما هو الجدول الدوري؟ وما الفرق بين العدد الذري والرقم الكتلي؟
جدول مندليف
حاول العالم الروسي مندليف تصنيف عناصر الجدول الدوري، من خلال ملاحظاته أن بعض العناصر لها خواص كيميائية وفيزيائية متشابه، وقد اعتبر مندليف هذا التشابه بمثابة مفتاح للكشف عن النماذج الخفية في العناصر.
ومن هنا قام بكتابة بطاقات دون عليها العناصر والحقائق الثابتة، وجعل لكل عنصر بطاقة مثبت عليها درجة الانصهار والكثافة واللون، والوزن الذري بذرة كل عنصر والقوة الترابطية له، وعدد الروابط التي يستطيع كل عنصر تكوينها.
عندما انتهى مندليف من تدوين البطاقات حاول تصنيفها بعدة طرق، ووقتها لاحظ ظهور نماذج من خلال ترتيب هذه العناصر حسب الزيادة في الكتلة الذرية، أو الوزن الذري فلاحظ أن القوة الترابطية للعناصر من الليثيوم إلى الفلورين تغيرت بطريقة مرتبة.
الجداول الحديثة
جميع الجداول الحديثة تحمل نفس المعلومات التي قام بوضعها مندليف في جدوله، ففي الجداول الحديثة تم وضع العناصر المتشابهة في الخواص على شكل أعمدة طولية، تعرف بالمجموعات أو العائلات والتي يقدر عددها ب 18 مجموعة.
تضم المجموعة 1 بالجدول معادن لينة تتفاعل مع الماء بشدة لتعطي غاز الهيدروجين، مما جعل العناصر الموجودة بالجدول الدوري مرتبة من اليسار إلى اليمين ومن أعلى لأسفل.
يحتوي الجدول على أكثر من 92 عنصر طبيعي فوق الأرض والعديد من العناصر الصناعية التي تم ابتكارها، وأحدث عنصر تم تحضيره به 116 برتون في نواة كل ذرة، وهذه العناصر الصناعية لم يطلق عليها أسماء رسمية حتى الآن.
المجموعة 2 في الجدول الدوري يطلق عليها المعادن الأرضية القلوية، التي تحوي إلكترونين في مدارها الخارجي.
تم نشر الجدول الدوري بأشكال وأحجام مختلفة، ولكن أكثر الجداول الحديثة المستعملة تبدأ بالمجموعة 1 يليها المجموعة 2 وهاتان المجموعتان تليهما مجموعة من الصفوف، مكونة من 10 أعمدة بها 40 عنصر وكل عمود يضم 4 عناصر.
استخدامات الجدول الدوري الحديث للعناصر
شاع استخدام الجدول الدوري في العديد من الأمور المتعلقة بعلم الكيمياء والفيزياء، والتي من ضمنها الآتي:
- دراسة العناصر والخواص الكيميائية والفيزيائية، ومعرفة الاختلافات فيما بينها.
- التنبؤ بخواص العناصر، وكيفية التفاعل مع العناصر الأخرى.
خواص العناصر
تنقسم العناصر الكيميائية إلى فلزات ولافلزات وأشباه فلزات، ولكل منهما خواصه وهى كالتالي:
أولاً: الفلزات
تتميز الفلزات بخصائص فيزيائية وكيميائية، وهى كالتالي:-
1- الخواص الفيزيائية
- اللمعان والبريق.
- موصلة جيدة للحرارة والكهرباء.
- تتميز بكثافتها العالية.
- درجة انصهارها عالية.
- يمكن سحبها لأسلاك.
- جميعها صلبة ما عدا الزئبق.
2- الخواص الكيميائية
- الإلكترونات تُفقد بسهولة.
- تتآكل بسرعة.
ثانياً: اللافلزات
تتمثل خصائص اللافلزات في الآتي:-
1- الخصائص الفيزيائية
- غير لامعة وبدون بريق.
- لا تسحب لأسلاك.
- رديئة التوصيل للحرارة والكهرباء.
- لا تطرق لألواح.
- كثافتها قليلة.
- درجة انصهارها منخفضة.
2- الخصائص الكيميائية
- تميل لاكتساب إلكترونات.
ولمعرفة المزيد من المعلومات حول الفلزات واللافلزات وخصائص كل منهما نوصي بالاطلاع على هذا المقال: مقارنة بين الفلزات واللافلزات وخصائص الفلزات وخصائص اللافلزات
ثالثاً: أشباه الفلزات
تتمثل خصائص أشباه الفلزات في الآتي:-
- صلبة.
- لامعة أو غير لامعة.
- يمكن سحبها لأسلاك.
- موصلة للحرارة والكهرباء، ولكن ليس بكفاءة المعادن.
- يمكن طرقها لألواح.
ولمعرفة ما هو العنصر الكيمائي الذي رمزه fe نوصي بالاطلاع على هذا المقال: عنصر كيمائي رمزه fe فما هو
من هنا نكون قد توصلنا إلى نهاية المقال بعد أن استعرضنا أهم المعلومات عن الجدول الدوري الحديث للعناصر وخواصه ونتمنى أن يكون المقال نال رضاكم وحاز على إعجابكم.
